基因编辑技术作为现代生物医学领域的革命性突破,正在深刻改变我们对生命科学的认知。自2012年CRISPR-Cas9基因编辑工具首次提出来,基因编辑技术迅速成为生命科学研究的热门领域。这一技术通过模拟细菌的免疫机制,利用特定的RNA引导Cas9蛋白在目标DNA位置进行切割,从而实现基因的精准编辑。近年来,基因编辑技术不断迭代发展,进一步拓展了基因编辑的应用范围。
劲帆生物医药科技(武汉)有限公司致力于为全球学术界、制药公司和生物技术企业的科学家们提供基因编辑一站式服务,公司已搭建一站式基因编辑服务平台,可提供从靶点筛选、基因编辑有效性检测和安全性评估的全流程解决方案。劲帆生物的研发团队凭借着深厚的技术积累,掌握了多种前沿基因编辑技术,包括CRISPR/Cas9基因编辑、碱基编辑(Base editor,BE)、先导编辑(prime editor,PE)、PASTE技术、CRISPRa/CRISPRi技术以及表观遗传编辑技术。团队已成功完成基因敲除、点突变、大片段插入、转录激活与抑制等基因编辑细胞系构建项目。各类编辑技术原理、应用以及特点如图1所示。
|
类别 |
技术名称 |
应用 |
应用范围 |
Cas蛋白 |
优点 |
缺点 |
|
DNA编辑 |
CRISPR/Cas DNA编辑技术 |
在DNA水平实现对基因敲除或外源基因/标签的定点敲入 |
1. 敲除/敲入目标基因细胞系的构建; 2. 敲除/敲入目标基因动物模型构建; 3. 临床前基因编辑药物验证; 4. 文库筛选(发现新靶点); 5. 药物研究(靶向病毒型角膜炎基因编辑药物BD111正在进行临床实验,临床表现较好) |
Cas9 Cas12a |
1. 相关质粒设计构建简便; 2. 能够编辑基因组的大多数区域 3. 成本低廉; |
1. 双链断裂可能导致染色体缺失、重排等问题; 2. 存在高脱靶效应、低效率等技术缺陷问题; |
|
DNA碱基 编辑技术 |
在DNA水平实现对单个碱基进行精确修改(ABE:A·T→G·C/CBE:C·G→T·A/GBE:C·G→G·C) |
1. 内源基因点突变细胞系的构建; 2. 临床前基因编辑药物验证; |
nCas9 nCas12a |
1. 精确靶向突变; 2. 高效编辑,低脱靶; |
1. 碱基突变位点受PAM序列的限制,很多预期突变位点靶点设计困难; 2. 产生突变类型相对单一; |
|
|
先导编辑技术 |
在DNA水平实现精准插入、缺失以及12种碱基替换的修改 |
1. 内源基因点突变、插入和缺失型突变细胞系的建立; 2. 临床前基因编辑药物验证; |
nCas9 nCas12a |
1. 精确靶向突变; 2. 广范的适用性12种单碱基之间的自由转换、多碱基的精准插入和删除 |
1. 编辑效率较低; 2. 编辑器表达框较大,体内递送难; |
|
|
PASTE技术 |
在DNA水平实现任意大小的DNA片段插入 |
应用于由大量基因突变引起的疾病(血友病、G6PD缺乏症、亨廷顿舞蹈症等)的细胞模型、动物模型的构建以及药物的开发; |
nCas9 nCas12a |
1. 高效定点地插入大片段的DNA; 2. 避免DNA双链断裂,减少染色体重排、缺失等副作用 |
1. 编辑器基因表达框大,体内递送难度大; 2. 技术还需优化; |
|
|
CRISPRa/CRISPRi |
实现对基因表达进行调控 (激活/抑制基因表达) |
1. 细胞系的构建; 2. 文库筛选(发现新靶点); |
dCas9 dCas12a |
高特异性地调控目标基因表达 |
1. 递送技术:需优化载体以靶向特定器官; 2. 基因的调控水平依赖于细胞类型,技术还需优化; |
|
|
表观遗传编辑技术 |
实现对基因表达进行调控 (甲基化修饰和去甲基化修饰) |
1. 基因功能研究,通过特异性地沉默或激活某些基因,观察其对细胞行为、发育和疾病发生发展的影响; 2. 药物研究(利用表观遗传编辑治疗乙肝和高胆固醇血脂症) |
dCas9 dCas12a |
1. 可逆性与可调控性 2. 可避免DNA断裂风险,安全性更高 3. 表观遗传修饰的改变可以通过细胞分裂和分化进行传递 |
1. 需优化载体(如LNP)以靶向特定器官; 2. 长期安全性:需验证甲基化标记的稳定性及潜在系统性副作用 |
|
|
RNA编辑 |
CRISPR/Cas13 RNA编辑技术 |
实现下调基因表达 (降解RNA) |
1. lncRNA和circRNA等非编码RNA的功能研究; 2. 药物研究(治疗新生血管性年龄相关性黄斑变性药物HG202已获得FDA批准用于临床实验) |
Cas13 |
不直接修改DNA序列,从而避免了脱靶效应和潜在的永久性遗传物质改变的风险 |
1. 编辑效率低; 2. 有旁切活性; 3. 体内递送技术不成熟; |
|
RNA碱基 编辑技术 |
实现对RNA单个碱基的进行精确修改 (A→I(G);U-ψ) |
药物研究 (目前更多地集中在临床前研究阶段) |
内源ADAR SnoRNP |
在mRNA水平上进行,这种操作是可逆的,为基因治疗提供了更高的灵活性和安全保障 |
1. 编辑效率低; 2. 体内递送技术不成熟 |
图1 DNA编辑技术
基因编辑工具载体是实现基因编辑技术的关键环节,它们负责将基因编辑组件(如Cas9蛋白、gRNA等)精准地递送到目标细胞中,从而确保基因编辑的成功。递送载体的选择和使用直接影响编辑效率和安全性。依托劲帆医药载体平台,我们可提供包含质粒、PiggyBac相关质粒、腺相关病毒、腺病毒、慢病毒以及病毒样颗粒(VLPs)等递送工具,以满足各类递送需求。各类递送工具的特点如图2所示。
|
类别 |
名称 |
Cas蛋白表达时间 |
递送片段大小 |
优点 |
缺点 |
应用 |
|
病毒载体 |
Adeno-associated virus
|
长 |
~4.7 kb |
1. 不会整合进宿主基因组; 2. 免疫原性低 |
1. 容量有限;
2. Cas蛋白的长期表达引起的免疫反应;
3. 重复给药问题;
|
1. 临床前动物实验
2. 临床研究(靶向HIV基因组的EBT-101目前在进行临床实验,表现较好的治疗效果)
|
|
Lentivirus
|
长 |
~8.5 kb |
1. 可以对包膜糖蛋白进行修饰,以靶向不同的细胞类型; 2. 可以递送不同大小的CRISPR Cargo; |
1. 会整合进入宿主基因组 |
1. 较难转染的敲除细胞株构建 2. sgRNA文库筛选 |
|
|
Adenovirus
|
长 |
8 kb-26 kb |
1. 不会整合进宿主基因组; 2. 可以容纳更大的CRISPR cargo; 3. 可以大量培养; |
1. 可能会引发不同的免疫反应; 2. 不适合靶向递送; |
1. PASTE技术的递送 2. 临床前动物研究 |
|
|
非病毒载体 |
LNP
|
短 |
~10 kb |
1. 没有病毒成分,安全性和免疫原性问题较少; 2. 以mRNA形式递送Cas9蛋白表达时间短,脱靶效率低。 |
1. 长片段mRNA合成过程中可能含有双链产物,造成免疫反应; 2. mRNA片段越大,空壳LNP概率越高; |
1. 临床前细胞和动物水平研究 2. 临床研究(NTLA-2001和NTLA-2002目前正在进行临床实验,表现出良好的治疗效果) |
|
VLPs
|
短 |
不限大小 |
1. 可以以核糖核蛋白(RNP)或mRNA形式递送Cas9蛋白,脱靶效率低; 2. 可以对VLPs包膜上糖蛋白进行靶向性改造; 3. 不含病毒成分,免疫原性低; |
规模化生产难度大 |
1. 临床前细胞和动物水平研究(T细胞中基因敲除等) 2. 临床研究(靶向病毒型角膜炎基因编辑药物BD111正在进行临床实验,临床表现较好BD111正在进行临床实验) |
|
|
PiggyBac Transposon
|
长或短 (可移除转座子) |
不限大小 |
1. 不限大小 2. 成本低,操作简单 3. “后悔”插入可以进行删除 |
转染效率低会影响整合效率 |
1. 临床前细胞水平研究(如CRISPRa相关细胞系的构建) 2. 临床研究(Car-T细胞系的构建-日本jRCTa040190099) |
图2 基因编辑递送载体
CRISPR/Cas9系统是目前最广泛应用的基因编辑工具,其主要依赖于Cas9蛋白和sgRNA的协同作用。sgRNA靶向识别目标DNA序列,引导Cas9蛋白在特定位点切割双链DNA,导致双链断裂(DSB)。随后,细胞内的修复机制被激活,包括非同源末端连接(NHEJ)和同源定向修复(HDR)。在NHEJ修复过程中,随机的碱基插入或缺失(Indel)可能引发基因功能缺失,实现基因敲除;而通过HDR修复,可以利用外源供体模板精确插入或替换特定序列,从而实现基因敲入或修改(图3)。
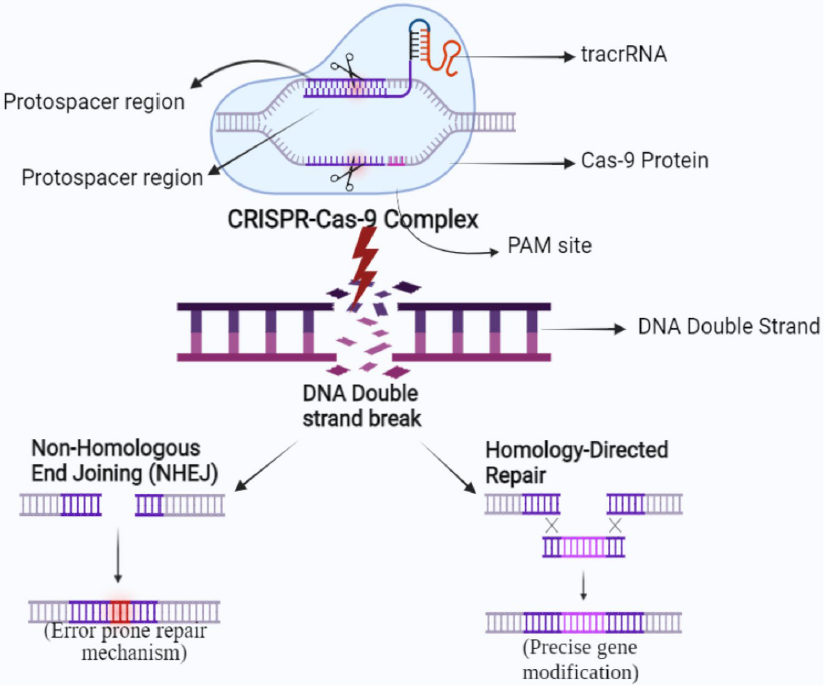
图3 CRISPR/Cas9 Mechanism (PMID: 36030476)
碱基编辑技术(BE)是CRISPR/Cas系统的进一步创新,能够在无需切割DNA双链的情况下,实现单个碱基的精准编辑,依据融合的碱基修饰酶种类不同可以分为胞嘧啶碱基编辑器(cytosine base editors,CBE)以及腺嘌呤碱基编辑器(adenine base editors,ABE)。其原理是将失活的dCas9与能够作用于单链的嘧啶或嘌呤脱氨酶融合,实现靶位点的碱基编辑(图4)。目前碱基编辑技术成功应用于遗传性视网膜疾病、镰状细胞症等疾病的治疗。
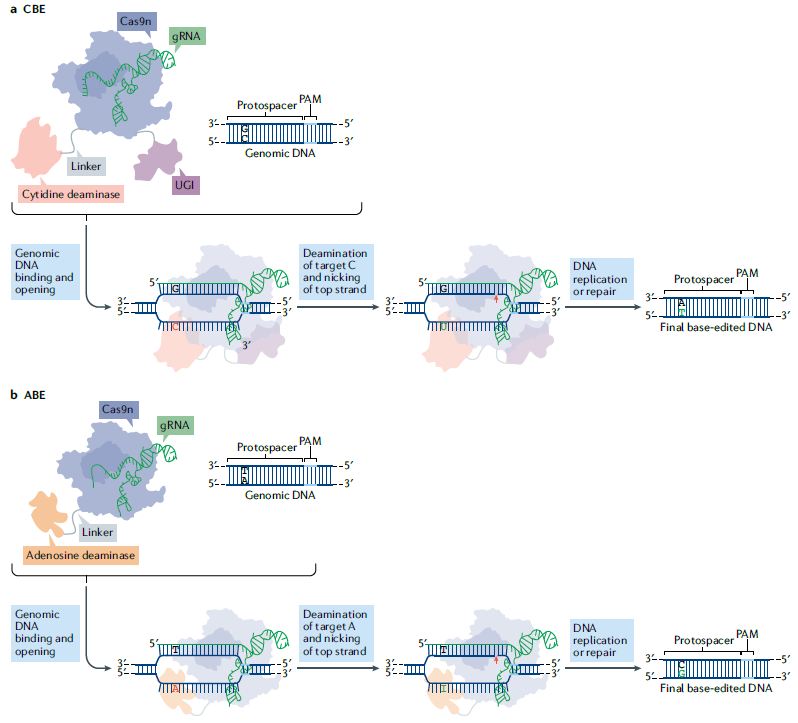
图4 DNA Base editing Mechanism (PMID: 33077937)
先导编辑技术(PE)由哈佛大学David Liu团队开发,能够实现更复杂和精确的基因编辑,即可实现靶向微小片段插入和缺失(允许编辑的长度约为44bp)以及十二种碱基替换。先导编辑技术的基本原理如图5所示。在pegRNA的引导下,nCas9切断含PAM的靶点DNA链。断裂后,靶DNA链与pegRNA 3’末端的PBS序列互补并结合。随后,逆转录酶开始沿着RT模板序列进行逆转录反应。反应结束后,DNA链的切口处会形成处于动态平衡中的5’和3’ flap结构,其中3’ flap结构的DNA链携带目标突变,而5’ flap结构的DNA链不含任何突变。细胞内,5’ flap结构易被结构特异性内切酶识别并切除。经过DNA连接和修复后,靶位点便实现了精准的基因编辑。劲帆医药利用这一技术,成功纠正了多个疾病相关基因的突变。
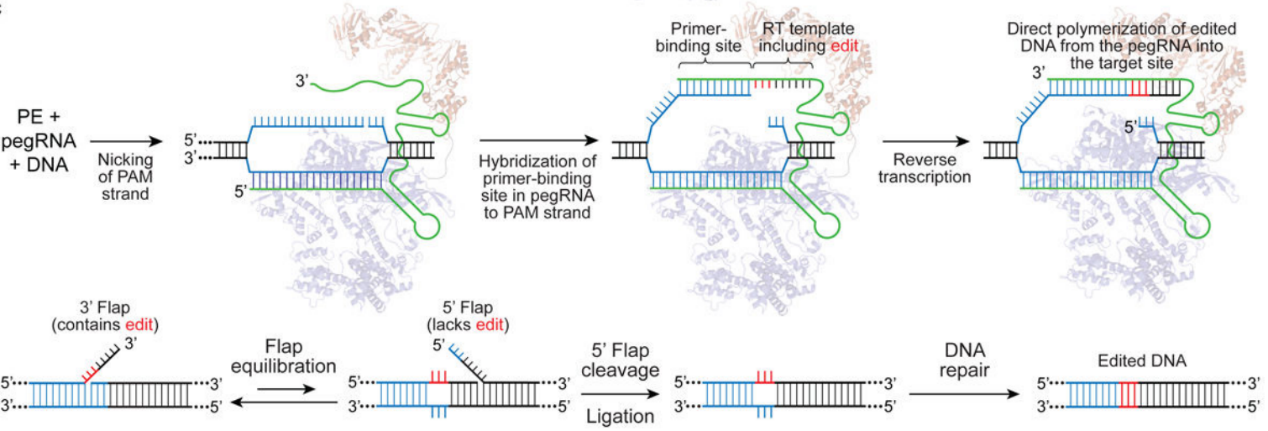
图5 Prime editing Mechanism (PMID: 31634902)
PASTE技术是一种基于先导编辑的新型基因编辑方法,能够将大片段DNA精准整合到基因组中,而不会引起DNA双链断裂。PASTE技术由两部分组成:首先是丝氨酸整合酶Bxb1与Cas9-MMLV RT复合体形成新的融合蛋白;其次是将丝氨酸整合酶约46bp attB着陆位点序列整合到pegRNA上,形成atgRNA。在该技术中,携带有整合酶附着位点attB的atgRNA,引导Cas9酶切割特定基因组位点,随后,Cas9酶与逆转录酶将整合酶所需要的附着位点序列attB(蓝色三角)整合进切割位点。最后,Bxb1整合酶会将目标基因序列(棕色三角,即attP序列和目标基因)整合进入attB位置(图6)。通过这种方式,PASTE技术可以将任何大小的DNA片段整合至基因组的任何位置。劲帆医药利用PASTE技术,成功实现了在哺乳动物细胞中的高效基因整合。
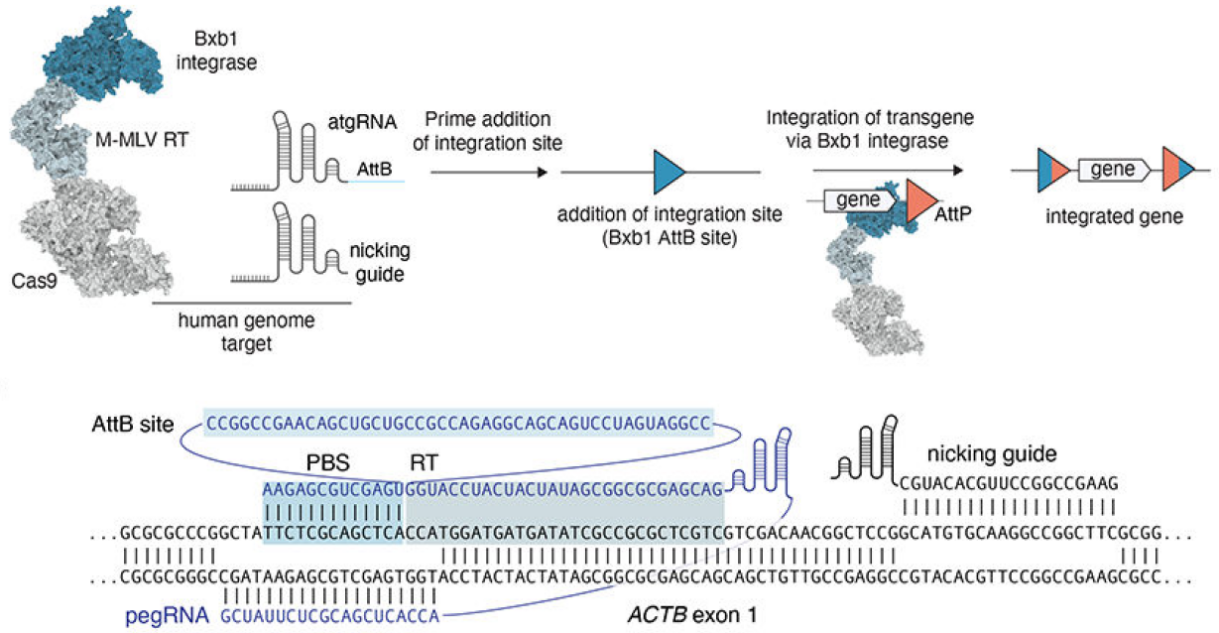
图6 Prime editing Mechanism (PMID: 31634902)
通过改造Cas9蛋白,使其失去切割能力但保留DNA结合能力,CRISPR/dCas9系统可以实现基因的转录激活(CRISPRa)或抑制(CRISPRi)(图7)。CRISPRi系统即利用dCas9和sgRNA联合使用,可以将该复合物精确地结合到目标基因的启动子区域和编码区域,阻碍转录因子的绑定和RNA聚合酶的功能,从而抑制基因的转录。CRISPRa系统将dCas9蛋白与具有转录激活功能的蛋白(VP64/VPR)融合,并与sgRNA联用,可以构建具有转录激活活性的系统。劲帆医药利用这一技术,成功调控了多个内源基因的表达,为疾病治疗提供了新的思路。
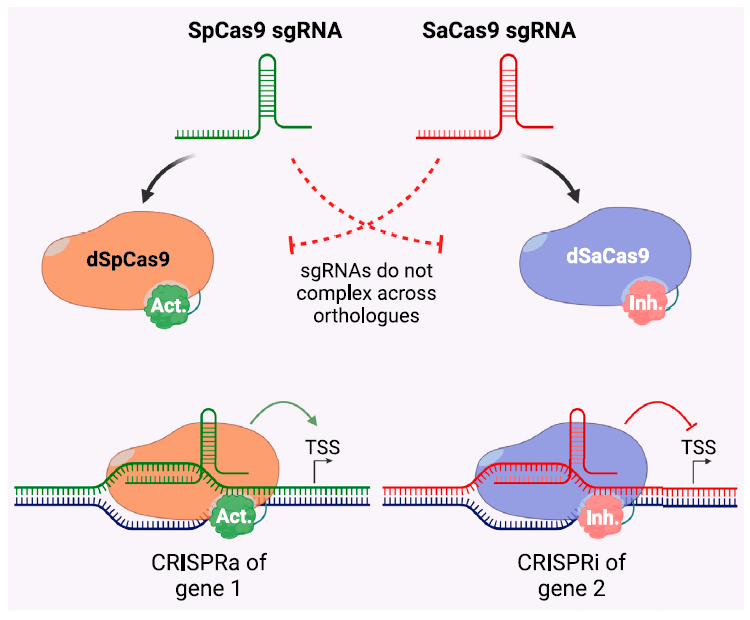
图7 CRISPRa and CRISPRi Mechanism (PMID: 36964659)
表观遗传编辑技术主要由dCas9与表观遗传修饰酶来进行融合,直接催化DNA或者组蛋白的表观修饰,调控基因的表达(图18)。例如,dCas9-DNMT3A已被证实可使DNA瞬时甲基化,从而抑制基因的表达。dCas9-TET1可以实现快速和瞬时DNA去甲基化,诱导靶基因的表达上调。dCas9-P300和dCas9-HDAC3可实现组蛋白高效的乙酰化和脱乙酰化,调控基因表达。由于表观遗传修饰引起的基因沉默可以通过细胞分裂和分化进行传递,因此其在疾病治疗中展现出独特优势。劲帆医药利用这一技术,成功调控了多个内源基因的表达,为疾病治疗提供了新的思路。
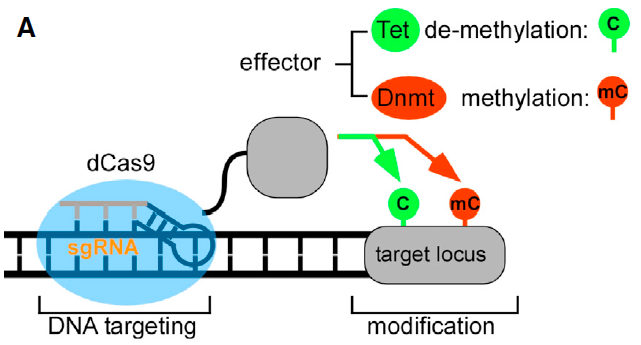
图8 DNA Methylation Editing Mechanism (PMID: 27662091)
|
服务类型 |
适用技术 |
技术应用场景 |
交付规格 |
|
DNA edit质粒 |
•CRISPR/Cas9/12a编辑技术 •碱基编辑技术 •先导编辑技术 •PASTE技术 •转录调控技术- (CRISPRa/CRISPRi) •表观遗传编辑技术 |
•定制化基因敲除 •定制化基因敲入 •定制化点突变 •定制化CRISPRa •定制化CRISPRi •定制化CRISPR Epigenome |
•标准规格质粒100 μg •根据客户需求 |
|
DNA edit Piggy Bac质粒 |
•转录调控技术 •表观遗传编辑技术 |
•定制化CRISPRa •定制化CRISPRi等 |
•标准规格质粒100 μg •根据客户需求 |
|
DNA edit慢病毒 |
•CRISPR/Cas9/12a编辑技术 •碱基编辑技术 •先导编辑技术 •PASTE技术 •转录调控技术- (CRISPRa/CRISPRi) •表观遗传编辑技术 |
•定制化基因敲除 •sgRNA文库 •定制化基因敲入 •定制化点突变 •定制化CRISPRa •定制化CRISPRi •定制化CRISPR Epigenome |
•标准规格病毒:1*108 TU •根据客户需求 |
|
DNA edit腺病毒 |
•CRISPR/Cas9/12a编辑技术 •碱基编辑技术 •先导编辑技术 •PASTE技术 •转录调控技术- (CRISPRa/CRISPRi) •表观遗传编辑技术 |
•定制化基因敲除 •定制化基因敲入 •定制化点突变 •定制化CRISPRa •定制化CRISPRi •定制化CRISPR Epigenome |
•标准规格病毒:1*1010 PFU •大包装规格病毒:1*1011 PFU •超大包装规格病毒:1*1012 PFU •根据客户需求 |
|
DNA edit腺相关病毒 |
•CRISPR/Cas9/12a编辑技术 •碱基编辑技术 •先导编辑技术 •PASTE技术 •转录调控技术- (CRISPRa/CRISPRi) •表观遗传编辑技术 |
•定制化基因敲除 •定制化基因敲入 •定制化点突变 •定制化CRISPRa •定制化CRISPRi •定制化CRISPR Epigenome |
•标准规格病毒:1*1011 GC •大包装规格病毒:1*1012 GC •超大包装规格病毒:1*1013 GC •根据客户需求 |
|
DNA edit VLPs |
•CRISPR/Cas9/12a编辑技术 •碱基编辑技术 •先导编辑技术 •表观遗传编辑技术 |
•定制化基因敲除 •定制化点突变 •定制化基因表达调控 |
•根据客户定制 |
|
服务类型 |
服务详情 |
细胞系选项 |
交付内容 |
交付周期 |
|
定制化敲除服务 |
单基因敲除稳定细胞株/细胞池 |
不限 |
1-2个经测序验证的全等位基因敲除细胞株/ 一个经测序验证的基因敲除细胞池 |
3-6周(细胞池) 9-15周(细胞株) |
|
多基因敲除稳定细胞株/细胞池 |
8-11周(细胞池) 16-24周(细胞株) |
|||
|
定制化敲入服务 |
点突变 |
不限 |
1-2个经测序验证的全等位基因敲除细胞株 |
16-24周(细胞株) |
|
目的基因的定点整合插入 |
||||
|
基因标签/报告基因的定点插入 |
||||
|
用于遗传变异研究的细胞模型构建(包括SNV,Indel等) |
||||
|
定制化表达调控服务 |
单基因表达调控稳定细胞株/细胞池 |
不限 |
1-2个经QPCR验证表达调控的细胞株/ 一个经QPCR验证表达调控的细胞池 |
3-6周(细胞池) 9-15周(细胞株) |
|
多基因表达调控稳定细胞株/细胞池 |
8-11周(细胞池) 16-24周(细胞株) |
备注:1.劲帆医药可提供的细胞系包括以下几种,肿瘤细胞系如HeLa、HCT116、HuH-7、HepG2、A549、A431、TE671、K562等;其他细胞系则涵盖HEK293T、HEK293、DC2.4、BHK等细胞系。若客户所需细胞系不在上述范围内,则需由客户自行提供相应的细胞系。

地址:中国武汉东湖高新区光谷七路128号 市场:17720522078 人事行政:027-62439686 邮箱:marketing@genevoyager.com
BD 商务总台:17720514121 /13886000399(BD 经理) /17720515371(BD 经理)
本公司所有产品仅供实验科研使用,不用于人体疾病治疗及临床诊断。